Các dạng bài bác tập về este là những bài xích toán thân quen và quan trọng đặc biệt trong lịch trình học THPT. Để tiến hành nhanh và đúng chuẩn nhất, các em bắt buộc nắm được các dạng bài xích tập về este và giải pháp giải. Vậy cụ thể để giải bài xích tập về este lipit cần nắm vững những loài kiến thức nào? Trong bài viết dưới đây, Tip.edu.vn sẽ ra mắt đến các bạn các dạng bài bác tập về este tương tự như cách giải thế thể, cùng khám phá nhé !.
Mục lục
Các dạng bài tập về este vào đề thi đại họcCác dạng bài bác tập về este của lipit trong đề thi đại học
Công thức phổ biến của este
Để giải các dạng bài tập về este, những em cần nắm rõ kiến thức lý thuyết cũng giống như công thức bao quát của este, rõ ràng như sau:

Các dạng bài bác tập về este trong đề thi đại học
Hình thức 1: Dạng bài bác tập bội phản ứng đốt cháy este
Phương pháp giải quyết
1 bội phản ứng đốt cháy esteEste no, đối chọi chức, mạch hởCTTQ: (C_ n H_ 2n O_ 2, n geq 2 )Phản ứng cháy: (C_ n H_ 2n O_ 2 + frac 3n -2 2 O_ 2 rightarrow n
CO_ 2 + n_ H_ 2 O ) (n_ CO_ 2 = n_ H_ 2 O ) (n_ O_ 2 = frac 3 2 n_ CO_ 2 – n_ este )Este không no, không no, mạch hở có một C = C. Liên kết
CTTQ: (C_ n H_ 2n-2 O_ 2, n geq 4 )Phản ứng cháy: (C_ n H_ 2n-2 O_ 2 + frac 3n-3 2 O_ 2 rightarrow n
CO_ 2 + (n-1) H_ 2 O ) (n_ CO_ 2> n_ H_ 2 O ) (n_ este = n_ CO_ 2 – n_ H_ 2 O )Este không no, đối chọi chức, gồm k liên kết C = C vào phân tử
CTTQ: (C_ n H_ 2n-2k O_ 2 )Este ko no, bao gồm 2 liên kết C = C trở lên trên trong phân tử (C_ n H_ 2n + 2-2k O_ m + O_ 2 rightarrow n
CO_ 2 + (n + 1-k) H_ 2 O ) (n_ CO_ 2> n_ H_ 2 O ) (n_ este = frac n_ CO_ 2 – n_ H_ 2 O k-1 )Bất kỳ este nào
CTTQ: (C_ x H_ y O_ z ). X, y, z số nguyên dương, (x geq 2, z geq 2 )Đốt cháy: (C_ x H_ y O_ z + O_ 2 rightarrow x
CO_ 2 + frac y 2 H_ 2 O )Vận dụng những định luật pháp bảo toàn khối lượng, định biện pháp bảo toàn nguyên tố… để giải bài tập.
Bạn đang xem: Các dạng bài tập về este và cách giải
Bài toán đốt cháy lếu hợp những esteBài toán đốt cháy 2 este đồng phânCác este đồng phân ( Rightarrow ) gồm cùng CTPT, cùng KLPT.Bài toán đốt cháy 2 este tạo thành từ và một axit, 2 ancol đồng đẳng hoặc cùng một ancol, 2 axit đồng đẳng.Các este này sẽ sở hữu cùng dạng CTQ ( Rightarrow ). Đặt CTPT trung bình để viết phương trình bội phản ứng, quay lại bài toán về 1 este.Số liên kết pi vào phân tử: (k = frac 2n_ C – n_ H + 2 2 )Bài toán đốt cháy hỗn hợp gồm nhiều este gồm cùng yếu tắc hoá học.Đặt CTPT trung bìnhÁp dụng những định phương pháp bảo toàn để giải các bài toán.
Ví dụ 1: Đốt cháy trọn vẹn 1,76 gam một este X chiếm được 3,52 gam (CO_ 2 ) cùng 1,44 gam (H_ 2 O ). Xác định công thức phân tử của X?
Giải pháp
Chúng ta có:
(n_ CO_ 2 = frac 3.52 44 = 0.08 , (mol) )
(n_ H_ 2 O = frac 1.44 18 = 0.08 , (mol) )
Vì (n_ CO_ 2 = n_ H_ 2 O Rightarrow ) X tất cả độ bão hòa phân tử ( Delta = 1 )
X là 1 trong este 1-1 chức ( Rightarrow ) X bao gồm dạng (C_ n H_ 2n O_ 2 )
Vậy phương pháp phân tử của X là: (C_ 4 H_ 8 O_ 2 )
Dạng 2: việc về bội nghịch ứng thủy phân este
Thủy phân một este đối chọi chứcTrong môi trường thiên nhiên axit: phản nghịch ứng thuận nghịch (RCOOR ‘+ HOH rightleftharpoons RCOOH + R’OH )Trong môi trường xung quanh kiềm (phản ứng xà chống hóa): bội phản ứng một chiều, bắt buộc đun nóng (RCOOR ‘+ NaOH overset t ^ circle rightarrow RCOOH + R’OH )Thủy phân este đa chức
Phương pháp giải quyết
Este đa chứcEste được tạo thành thành từ một axit 1-1 chức và một rượu nhiều chức (n chức): ((RCOO) _ n R ‘)
((RCOO) _ n R ‘+ n
Na
OH mũi tên đề xuất n
RCOONa + R’ (OH) _ n )
Este được tạo thành xuất phát điểm từ một axit nhiều chức (n chức) và một rượu đối chọi chức: (R (COOR ‘) _ n )Este được tạo nên thành xuất phát điểm từ một axit đa chức (n chức) và một rượu nhiều chức (m chức): (R_ m (COOR ‘) _ nm R’ _ n ). Lúc n = m phát triển thành (R (COOR ‘) n
R’ rightarrow ) este mạch vòng
Ester no, 2 chức năng, mạch hở: (C_ n H_ 2n-2 O_ 4 )Khi thuỷ phân một este đa chức, tỉ lệ: ( frac n_ Na
OH N_ este> 1 )Nếu T = 2 ( Rightarrow ) Este có 2 tính năng thì T = 3 ( Rightarrow ) Este bao gồm 3 chức năng…
Ví dụ 2: Để thủy phân 5,6 gam hỗn hợp tất cả etyl axetat cùng etyl fomat (etyl fomat) cần 25,96 ml dd Na
OH 10% (D = 1,08 g / ml). Thành phần% trọng lượng của etyl axetat trong tất cả hổn hợp là?
Giải pháp
call x là số mol (CH_ 3 COOC_ 2 H_ 5 ) và y là số mol (HCOOC_ 2 H_ 5 ).
Phương trình phản nghịch ứng:
(CH_ 3 COOC_ 2 H_ 5 + Na
OH mũi tên nên CH_ 3 COONa + C_ 2 H_ 5 OH ) (đầu tiên)
(HCOOC_ 2 H_ 5 + Na
OH rightarrow HCOONa + C_ 2 H_ 5 OH ) (2)
Theo giả thiết và phản ứng, ta có hệ phương trình:
( left { begin matrix 88x + 74y = 5.6 x + y = 0.07 kết thúc matrix right Leftrightarrow left { begin matrix x = 0, 03 y = 0.04 over matrix right. )
( Rightarrow )% (m_ CH_ 3 COOC_ 2 H_ 5 = 47,14 )%.
Dạng 3: Dạng bài tập về bội nghịch ứng hóa học của este
Ví dụ 3: xong sơ thiết bị phản ứng sau:
Giải pháp
Tổng hòa hợp kiến thức bài tập cơ bản về este
Các dạng bài bác tập về este của lipit trong đề thi đại học
Loại 1: Thủy phân lipit trong môi trường axit
Trong công nghiệp, phản nghịch ứng bên trên được tiến hành trong nồi hấp ngơi nghỉ (220 ^ circle C ) và 25 atm.
Loại 2: làm phản ứng xà chống hóa lipid
Khi đun cho nóng với dung dịch kiềm (Na
OH hoặc KOH) sẽ tạo nên ra glixerol và tất cả hổn hợp muối của axit béo. Muối bột natri hoặc muối hạt kali của axit khủng là xà phòng.
Phản ứng của chất lớn với hỗn hợp kiềm được gọi là phản bội ứng xà chống hóa. Phản ứng xà phòng hóa cấp tốc hơn phản ứng thủy phân trong môi trường axit với là bội phản ứng không thuận nghịch.
Chỉ số xà chống hóa: là số mg KOH dùng để xà chống hóa trọn vẹn 1 gam lipit (tức là để trung hòa axit hình thành khi thủy phân 1 gam lipit).Số axit: số mg KOH dùng làm trung hòa axit tự do có trong một mg lipid.Ví dụ 4: Cần từng nào kg chất to chứa 89% khối lượng là tristearin (đã loại trừ 11% tạp hóa học trơ trong quá trình làm xà phòng) để cung ứng 1 tấn xà phòng chứa 72% khối lượng natri stearat.
Giải pháp
Trong 1 tấn xà phòng bao gồm 72% cân nặng là natri stearat.
( Rightarrow m_ C_ 17 H_ 35 COONa = 720kg )
Khối lượng của chất bự là: ( frac 702,63,100 89 = 789,47kg )
Trên đó là những tổng vừa lòng của Tip.edu.vn về công ty đề bài tập về este và phương thức giải những bài tập khó về este. Hy vọng những con kiến thức trong nội dung bài viết đã hỗ trợ cho chúng ta những thông tin cần thiết về chủ đề bài xích tập về este. Chúc may mắn với các nghiên cứu của bạn!
Xem chi tiết qua video clip của thầy giáo Vũ xung khắc Ngọc:
Các khoa liên quan:
bài tập cơ bản về estebài tập về este tímbài tập về este nhiều chức.bài tập biến đổi estebài tập kim chỉ nan estebài tập về este hay cùng khóbài tập phản ứng este hóabài tập bội phản ứng este hóaphương pháp giải những bài tập nặng nề về esteCác dạng bài bác tập về este lipit có lời giảiBài tập trắc nghiệm về este lipit tất cả đáp ánCác dạng bài bác tập về este trong đề thi đại họcPhương pháp giải những dạng bài xích tập chương Este, Lipit
Với phương pháp giải những dạng bài bác tập chương Este, Lipit Hoá học tập lớp 12 tổng hợp các dạng bài xích tập, bài bác tập trắc nghiệm bao gồm lời giải cụ thể với đầy đủ cách thức giải, ví dụ như minh họa để giúp học sinh ôn tập, biết phương pháp làm dạng bài bác tập chương Este, Lipit từ đó đạt điểm cao trong bài bác thi môn Hoá học tập lớp 12.

Bài tập trắc nghiệm
Phương pháp giải bài xích tập phản bội ứng đốt cháy este
A. Cách thức & Ví dụ
Lý thuyết và phương pháp giải
CTTQ este: Cn
H2n+2-2k-2x
O2x
PT tổng quát
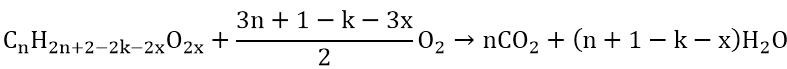
TH este no, đối chọi chức
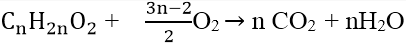
&r
Arr; n
H2O = n
CO2 ; neste = 1,5n
CO2 - n
O2
&r
Arr; Số nguyên tử C là
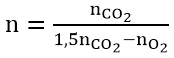
Trường vừa lòng đốt cháy một tất cả hổn hợp nhiều este thuộc thuộc dãy đồng đẳng thì ta cũng tóm lại tương tự như trên.
nhỗn đúng theo = 1,5n
CO2 - n
O2
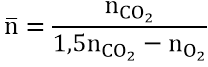
làm việc đây:
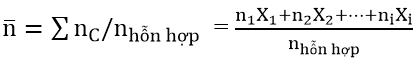
khác với axit cacboxylic quý giá n– vào este luôn lớn hơn 2.
Ví dụ minh họa
Bài 1: Đốt cháy hoàn toàn 7,4 gam este X solo chức chiếm được 6,72 lít khí CO2 (đktc) và 5,4 gam nước. Xác định công thức phân tử của X.
Hướng dẫn:
Ta có: n
CO2 = 6,72/22,4 = 0,3 (mol) với n
H2O = 5,4/18 = 0,3 (mol)
vì khi đốt cháy X thu được n
H2O = n
CO2 bắt buộc X là este no đối chọi chức
Gọi phương pháp của este no, solo chức là: Cn
H2n
O2 (n ≥ 2)
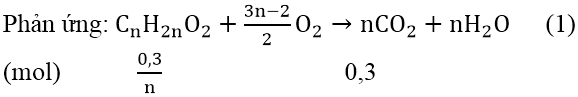
Theo đề bài, ta có: MX = (0,3/n).(14n + 32) = 7,4 &r
Arr; n = 3
Vậy phương pháp phân tử của X là: C3H6O2.
Bài 2: Đốt cháy hoàn toàn 1,76 gam một este X nhận được 3,52 gam CO2 cùng 1,44 gam H2O. Khẳng định công thức phân tử của X?
Hướng dẫn:
Ta có: n
CO2 = 3,52/44 = 0,08 (mol); n
H2O = 1,44/18 = 0,08(mol)
vị n
CO2 = n
H2O &r
Arr; X bao gồm độ bất bão hòa của phân tử ∆ = 1
X là este no, đơn chức &r
Arr; X dạng Cn
H2n
O2
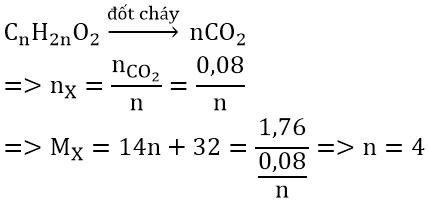
Vậy phương pháp phân tử của X là: C4H8O2
Bài 3: Đốt cháy trọn vẹn 4,2 gam một este E chiếm được 6,16 gam CO2 cùng 2,52 gam H2O. Xác minh công thức phân tử , công thức cấu tạo , điện thoại tư vấn tên E.
Hướng dẫn:
Ta có; n
CO2 = 6,16/44 = 0,14(mol); n
H2O = 2,52/18 = 0,14 (mol)
bởi n
CO2 = n
H2O &r
Arr; ∆ = 1 &r
Arr; E là este no,đơn chức dạng: Cn
H2n
O2
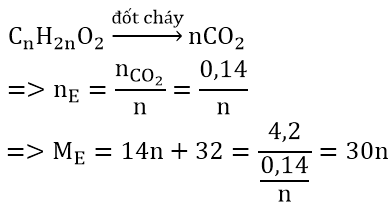
n = 2 &r
Arr; C2H4O2 &r
Arr; CTPT của E là HCOOCH3 (metyl fomiat)
Bài 4: Đốt cháy trọn vẹn một lượng tất cả hổn hợp hai este, cho thành phầm phản ứng cháy qua bình đựng P2O5 dư, khối lượng bình tăng thêm 6,21 gam, tiếp đến cho qua tiếp dung dịch Ca(OH)2 dư, nhận được 34,5 gam kết tủa. Những este nói bên trên thuộc một số loại gì (đơn chức hay đa chức, no hay là không no)?
Hướng dẫn:
cân nặng tăng lên của bình P2O5 là trọng lượng H2 O
P2O5 + 3H2O → 2H3PO4
gồm kết tủa sinh sản thành là do CO2 hấp thụ
CO2 + Ca(OH)2 → Ca
CO3 + H2O
Ta có: n
Ca
CO3 = 34,5/100 = 0,345 (mol)
n
H2O = 6,21/18 = 0,345 (mol); n
CO2 = n
Ca
CO3 = 0,345 (mol)
Số mol H2O = số mol của CO2 &r
Arr; ∆ = 1
bởi đó, nhị este mọi no, solo chức
Bài 5: Đốt cháy trọn vẹn 3,7 gam một este đối chọi chức X chiếm được 3,36 lít khí CO2 (đktc) cùng 2,7 gam nước. Tìm bí quyết phân tử của X.
Hướng dẫn:
ta có: n
CO2 = 3,36/22,4 = 0,15 (mol) với n
H2O = 2,7/18 = 0,15 (mol)
do n
CO2 = n
H2O &r
Arr; este no,đơn chức
Gọi phương pháp este no, đơn chức là: Cn
H2n
O2 (n ≥ 2)
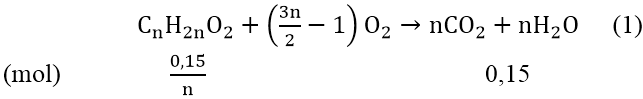
Theo đề bài, ta bao gồm phương trình:
m
X = (0,15/n).(14n + 32) = 3,7 &r
Arr; 2,1n + 4,8 = 3,7n &r
Arr; n = 3
Vậy phương pháp phân tử của X là: C3H6O2
B. Bài bác tập trắc nghiệm
Bài 1: hỗn hợp X gồm 2 este no, đối chọi chức, mạch hở. đốt cháy trọn vẹn một lượng X yêu cầu dùng vừa đủ 3,976 lít khí oxi (đktc), nhận được 6,38 gam CO2. Mặt khác, X tác dụng với hỗn hợp Na
OH , chiếm được một muối cùng hai ancol là đồng đẳng kế tiếp. Công thức phân tử của nhì este trong X là :
A. C2H4O2 với C5H10O2 B. C2H4O2 cùng C3H6O2
C. C3H4O2 cùng C4H6O2 D. C3H6O2 với C4H8O2
Lời giải:
Đáp án: B
khi thủy phân X bời dung dịch Na
OH, chiếm được muối cùng hai ancol là đồng đẳng liên tiếp X tất cả hai este no, đơn chức, mạch hở đồng đẳng kế tiếp.
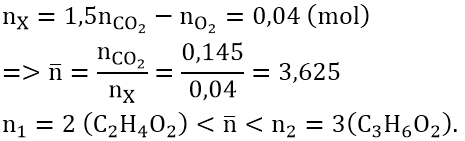
Bài 2: Đốt cháy trọn vẹn 10 ml một este đề nghị dùng hết 45 ml O2, nhận được VCO2: VH2O = 4: 3. Ngưng tụ sản phẩm cháy thấy thể tích sút 30 ml. Các thể tích đo ở thuộc điều kiện. Phương pháp của este sẽ là :
A. C8H6O4. B. C4H6O2. C. C4H8O2 D. C4H6O4.
Lời giải:
Đáp án: B
Đối với những chất khi và hơi, tỉ lệ về thể tích bởi tỉ lệ về số mol nên hoàn toàn có thể áp dụng định luật bảo toàn nguyên tố theo thể tích của các chất.
Theo trả thiết suy ra: VH2O = 30 ml ; VCO2 = 40 ml
Sơ thứ phản ứng:
Cx
Hy
Oz + O2 → CO2 + H2O
Áp dụng định luật pháp bảo toàn nguyên tố cho những nguyên tố C, H, O ta gồm :
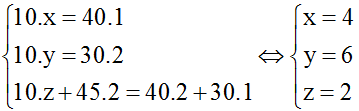
Vậy este gồm công thức là C4H6O2.
Bài 3: Đốt cháy hoàn toàn 2,28 gam X phải 3,36 lít oxi (đktc) thu các thành phần hỗn hợp CO2 cùng H2O tất cả tỉ lệ thể tích tương ứng 6: 5. Ví như đun X trong dung dịch H2SO4 loãng chiếm được axit Y bao gồm d
Y/H2 cùng ancol 1-1 chức Z. Phương pháp của X là :
A. C2H5COOC2H5. B. CH3COOCH3.
C. C2H3COOC2H5. D. C2H3COOC3H7.
Lời giải:
Đáp án: D
vày VCO2: VH2O = n
CO2: n
H2O = 6: 5 &r
Arr; n
C: n
H = 6: 10 = 3: 5.
Bài 4: Đốt cháy trọn vẹn 0,11 gam một este X ( tạo nên từ một axit cacboxylic đối kháng chức và một ancol đơn chức) nhận được 0,22 gam CO2 với 0,09 gam H2O. Số este đồng phân của X là:
A. 2. B. 5. C. 6. D. 4.
Lời giải:
Đáp án: D
Số mol CO2 thông qua số H2O bằng 0,005 buộc phải X là este no, đối chọi chức Cn
H2n
O2.
Cn
H2n
O2 → n
CO2
Ta gồm hệ :
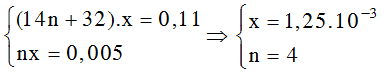
Số este đồng phân của X là 4.
HCOOCH2CH2CH3 ; HCOOCH(CH3)CH3 ; CH3COOCH2CH3 ; CH3CH2COOCH3.
Bài 5: các thành phần hỗn hợp X gồm vinyl axetat, metyl axetat với etyl fomat. Đốt cháy hoàn toàn 3,08 gam X, thu được 2,16 gam H2O. Tỷ lệ số mol của vinyl axetat trong X là :
A. 25%. B. 27,92%. C. 72,08%. D. 75%.
Lời giải:
Đáp án: A
tất cả hổn hợp X gồm CH3COOCH=CH2; CH3COOCH3; HCOOC2H5.
Đặt công thức chung của bố chất là
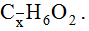
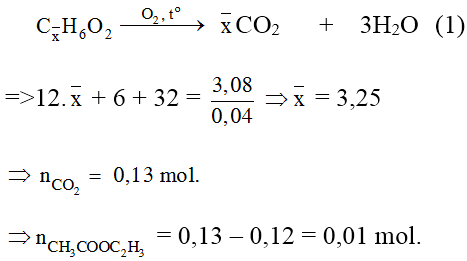
phần trăm về số mol của CH3COOC2H3 = 25%.
Bài 6: Đốt cháy trọn vẹn 3,42 gam láo hợp tất cả axit acrylic, vinyl axetat, metyl acrylat và axit oleic, rồi hấp thụ toàn cục sản phẩm cháy vào dung dịch Ca(OH)2 (dư). Sau bội nghịch ứng chiếm được 18 gam kết tủa với dung dịch X. Khối lượng X so với trọng lượng dung dịch Ca(OH)2 lúc đầu đã biến đổi như cầm cố nào ?
A. Tăng 2,70 gam. B. Sút 7,74 gam.
C. Tăng 7,92 gam. D. Giảm 7,38 gam.
Lời giải:
Đáp án: D
các chất đề cho đều có dạng Cn
H2n-2O2. Đặt phương pháp phân tử trug bình của những chất là
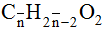
Sơ vật dụng phản ứng :
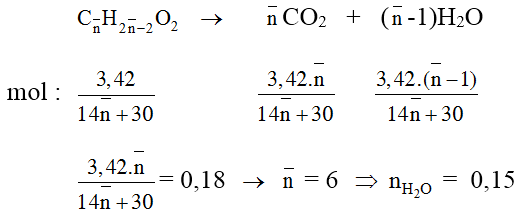
Vậy dung dịch sau bội phản ứng sút so với hỗn hợp X là:
m
Ca
CO3 - (m
CO2 + m
H2O) = 7,38 gam.
Bài 7: Đốt cháy 6 gam este E nhận được 4,48 lít CO2 (đktc) và 3,6 gam H2O. Biết E tất cả phản ứng tráng gương với dung dịch Ag
NO3/NH3. Công thức cấu trúc của E là:
A. CH3COOCH2CH2CH3. B. HCOOCH2CH2CH3.
C. HCOOC2H5. D. HCOOCH3.
Lời giải:
Đáp án: D
Đốt cháy E nhận được mol cần E là este no, 1-1 chức, mạch hở gồm công thức phân tử là Cn
H2n
O2.
Sơ trang bị phản ứng:
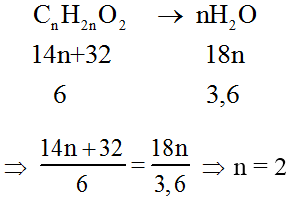
E là C2H4O2(HCOOCH3).
Bài 8: Đốt cháy hoàn toàn 0,1 mol X chỉ đựng nhóm chức este ta chiếm được 4.48 lít CO2 (đktc) với 3,6 gam H2O. CTPT của este X hoàn toàn có thể là:
A. C6H8O2
B. C4H8O4
C. C2H4O2
D. C3H6O2
Lời giải:
Đáp án: C
Ta có: n
CO2 = 4,48/22,4 = 0,2 (mol); n
H2O = 3,6/18 = 0,2 (mol)
0,1 mol este lúc chát tạo ra 0,2 mol CO2 với 0,2 mol H2O bắt buộc este là C2H4O2.
Cách giải bài bác tập về bội nghịch ứng thủy phân este
A. Phương pháp & Ví dụ
Lý thuyết và phương pháp giải
Với este đối kháng chức
+ Trong bội phản ứng thủy phân este đối kháng chức thì tỉ lệ thành phần n
Na
OH: n este = 1:1 Riêng bội phản ứng thủy phân este của phenol thì tỉ lệ thành phần là n
Na
OH: n este = 2:1
+ làm phản ứng thủy phân este thu được anđehit thì este phải bao gồm công thức là RCOOCH=CH–R’.
+ phản ứng thủy phân este nhận được xeton thì este phải có công thức là RCOOC(R’’)=CH–R’.
(R’ có thể là nguyên tử H hoặc cội hiđrocacbon, R’’ cần là nơi bắt đầu hiđrocacbon ).
+ Este rất có thể tham gia phản nghịch ứng tráng gương thì phải tất cả công thức là HCOOR.
+ Este sau khoản thời gian thủy phân cho sản phẩm có tác dụng tham gia phản nghịch ứng tráng gương thì phải bao gồm công thức là HCOOR hoặc RCOOCH=CH–R’.
Xem thêm: Gương Mặt Tỉ Lệ Vàng Nam - Tỷ Lệ Vàng Khuôn Mặt Đẹp Nam/Nữ
+ nếu như thủy phân este trong môi trường kiềm mà đề bài xích cho biết: “...Sau khi thủy phân hoàn toàn este, cô cạn dung dịch được m gam hóa học rắn” thì trong hóa học rắn thường có cả Na
OH hoặc KOH dư.
+ ví như thủy phân este mà trọng lượng các chất tham gia bội nghịch ứng bằng cân nặng của sản phẩm tạo thành thì este đem thủy phân là este vòng.
Với este đa chức
+ Trong làm phản ứng thủy phân este nhiều chức thì tỉ lệ n
Na
OH: n este > 1
ví như T = 2 Este gồm 2 chức, T = 3 Este có 3 chức...
+ Este đa chức hoàn toàn có thể tạo thành từ ancol nhiều chức với axit solo chức; ancol 1-1 chức với axit đa chức; cả axit với ancol phần đông đa chức; hợp chất tạp chức với các axit cùng ancol đối chọi chức.
Ví dụ minh họa
Bài 1: mong thuỷ phân 5,6 gam hỗn hợp etyl axetat và etyl fomiat (etyl fomat) bắt buộc 25,96 ml Na
OH 10% (D = 1,08 g/ml). Nguyên tố % trọng lượng của etyl axetat trong các thành phần hỗn hợp là :
A. 47,14%. B. 52,16%. C. 36,18%. D. 50,20%.
Hướng dẫn:
Đặt x là số mol CH3COOC2H5 và y là số mol HCOOC2H5.
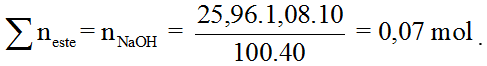
Phương trình phản ứng:
CH3COOC2H5 + Na
OH → CH3COONa + C2H5OH (1)
HCOOC2H5 + Na
OH → HCOONa + C2H5OH (2)
Theo đưa thiết và những phản ứng ta gồm hệ phương trình :
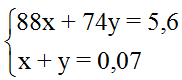
&r
Arr; x = 0,03 với y = 0,04.
&r
Arr; % m
CH3COOC2H5 = 47,14%.
Đáp án A.
Bài 2: cho m gam hóa học hữu cơ đối chọi chức X tính năng vừa đủ với 50 gam dung dịch Na
OH 8%, sau thời điểm phản ứng trọn vẹn thu được 9,6 gam muối bột của một axit hữu cơ và 3,2 gam một ancol. Phương pháp của X là :
A. CH3COOC2H5. B. C2H5COOCH3.
C. CH2=CHCOOCH3. D. CH3COOCH=CH2.
Hướng dẫn:
Đặt phương pháp của X là RCOOR’.
Theo mang thiết ta bao gồm :
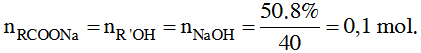
MR’OH = R’+ 17 = 32 R’= 15 (CH3–) cùng MRCOONa = R + 67 = 96
R = 29(C2H5–).
Vậy phương pháp của X là C2H5COOCH3.
Đáp án B.
Bài 3: Một este X tạo vày axit solo chức và ancol đơn chức có tỉ khối cùng với He bằng 22. Khi nấu nóng X với hỗn hợp Na
OH tạo thành muối có trọng lượng bằng 17/22 lượng este đang phản ứng. Tên X là:
A. Etyl axetat. B. Metyl axetat.
C. Iso-propyl fomat. D. Metyl propionat.
Hướng dẫn:
Este gồm công thức dạng RCOOR’, muối sản xuất thành là RCOONa.
Phương trình phản nghịch ứng :
RCOOR’ + Na
OH → RCOONa + R’OH
bởi số mol este bằng số mol muối, buộc phải tỉ lệ về cân nặng của bọn chúng cũng là tỉ trọng về trọng lượng mol.
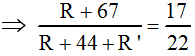
&r
Arr; 17R’ - 5R = 726 (1).
còn mặt khác Meste = 4.22 = 88 &r
Arr; R + 44 + R’ = 88 &r
Arr; R + R’ = 44 (2).
tự (1) và (2) ta có: R = 1 (H-); R’ = 43 (C3H7-). Vậy tên este là iso-propyl fomat
Bài 4: Xà chống hóa 8,8 gam etyl axetat bởi 200 ml hỗn hợp Na
OH 0,2M. Sau thời điểm phản ứng xẩy ra hoàn toàn, cô cạn dung dịch sau bội phản ứng thu được bao nhiêu gam muối khan?
Hướng dẫn:
Ta có: n
CH3COOC2H5 = 5,5/88 = 0,1 (mol)
cùng n
Na
OH lúc đầu = 0,2 .0,2 = 0,04 (mol)
Este dư, Na
OH hết
CH3COOC2H5 + Na
OH → CH3COONa + C2H5OH (1)
từ bỏ (1) &r
Arr; n
CH3 COONa = n
Na
OH = 0,04 (mol)
m
CH3 COONa = 0,04 .82 = 3,28(gam)
Bài 5: Este X được tạo thành từ bỏ etylen glicol cùng hai axit cacboxylic đơn chức. Vào phân tử este, số nguyên tử cacbon nhiều hơn thế số nguyên tử oxi là 1. Khi mang đến m gam X công dụng với dung dịch Na
OH (dư) thì lượng Na
OH đang phản ứng là 10 gam. Cực hiếm của m là :
A. 14,5. B. 17,5. C. 15,5. D. 16,5.
Hướng dẫn:
Theo mang thiết ta cho thấy X là este hai chức của etylen glicol với axit hữu cơ solo chức; X có 4 nguyên tử O và bao gồm 5 nguyên tử C.
Vậy phương pháp của X là: HCOOC2H4OOCCH3
Phương trình phản nghịch ứng :
HCOOC2H4OOCCH3 + 2Na
OH → HCOONa + CH3COONa + C2H4(OH)2
Theo đưa thiết cùng (1) ta có: n
HCOOC2H4OOCCH3 = một nửa n
Na
OH = 1/2 . 10/40 = 0,125 mol
Vậy m
X = 0,125.132 = 16,5 gam.
B. Bài tập trắc nghiệm
Bài 1: Để xà phòng hóa 17,4 gam một este no đối kháng chức buộc phải dùng 300 ml dung dịch Na
OH 0,5M. Tìm phương pháp phân tử của este rước dùng.
A. C6H12O2 B. C5H10O2
C. C4H8O2 D. C6H10O2
Vậy công thức phân tử của este là C6H12O2)
Lời giải:
Đáp án: A
Gọi phương pháp của este no, đơn chức là Cn
H2n
O2
lúc xà chống hóa thì: neste = n
Na
OH
neste = 0,3 .0,5 = 0,15 (mol) &r
Arr; Meste = 17,4/0,15 = 116
14n + 32 = 116 &r
Arr; n = 6
Bài 2: Thủy phân hoàn toàn 8,8 gam este đối chọi chức, mạch hở X cùng với 100 ml dung dịch KOH 1M (vừa đủ ) chiếm được 4,6 gam một ancol Y. Khẳng định tên gọi của X.
A. CH3COOCH3 B. HCOOC2H5
C. CH3COOC2H5 D. C2H5COOC2H5
Lời giải:
Đáp án: C
Gọi cách làm este đơn chức X là RCOOR"
Ta có: n
KOH = 0,1*1 = 0,1(mol)
RCOOR" + KOH → RCOOK + R"OH (1)
trường đoản cú (1) &r
Arr; n
R"OH = 0,1(mol) &r
Arr; MR"OH = 4,6/0,1 = 46
&r
Arr; R" = 29 &r
Arr; C2H5-
Y: C2H5OH &r
Arr; X là CH3COOC2H5( vị MX = 88): etyl axetat
Bài 3: E là este của một axit đơn chức và ancol solo chức. Để thủy phân hoàn toàn 6,6 gam chất E yêu cầu dùng 34,1 ml dung dịch Na
OH 10% (d = 1,1 g/ml). Lượng Na
OH này dùng dư 25% đối với lượng Na
OH bội nghịch ứng. Công thức cấu trúc đúng của E là:
A. CH3COOCH3
B. HCOOC3H7
C. CH3COOC2H5
D. Cả B và C những đúng
Lời giải:
Đáp án: D
Ta có:
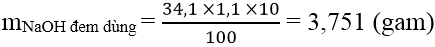
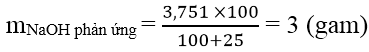
&r
Arr; ME = 88 gam &h
Arr; R + 44 + R’ = 88 &r
Arr; R + R’ = 44
- khi R = 1 &r
Arr; R’ = 43 (C3H7) &r
Arr; CTCT (E): HCOOC3H7(propyl fomiat)
- khi R = 15 &r
Arr; R’ = 29 &r
Arr; CTCT (E): CH3COOC2H5 (etyl axetat)
Bài 4: Để xà chống hóa 17,4 gam một este no đơn chức buộc phải dùng 300 ml hỗn hợp Na
OH 0,5M. Cách làm phân tử của este là:
A. C3H66O2
B. C5H10O2
C. C6H12O2
D. C4H10O2
Lời giải:
Đáp án: C
Gọi cách làm của este no, đối chọi chức là Cn
H2n
O2
&r
Arr; neste = n
Na
OH
&r
Arr; neste = 0,3 x 0,5 = 0,15 (mol) &r
Arr; Meste = 17,4/0,15 = 116
&r
Arr; 14n + 32 = 116 &r
Arr; n = 6
Vậy phương pháp phân tử của este là C6H12O2.
Bài 5: mang đến axit salixylic (axit o-hiđroxibenzoic) làm phản ứng cùng với anhiđrit axetic, chiếm được axit axetylsalixylic (o-CH3COO–C6H4–COOH) cần sử dụng làm thuốc cảm (aspirin). Để phản bội ứng hoàn toàn với 43,2 gam axit axetylsalixylic đề xuất vừa đầy đủ V lít hỗn hợp KOH 1M. Giá trị của V là :
A. 0,72. B. 0,48. C. 0,96. D. 0,24.
Lời giải:
Đáp án: A
o-CH3COO–C6H4–COOH + 3KOH → CH3COOK + o-KO–C6H4–COOK + H2O (1)
&r
Arr; n
KOH = 3.no-CH3COO–C6H4–COOH = 3 . 43,2/180 = 0,72 mol
Bài 6: Xà chống hoá 22,2 gam láo hợp bao gồm 2 este đồng phân, cần dùng 12 gam Na
OH, thu 20,492 gam muối khan (hao hụt 6%). Vào X chắc chắn rằng có một este với cách làm và số mol tương xứng là :
A. HCOOC2H5 0,2 mol. B. CH3COOCH3 0,2 mol.
C. HCOOC2H5 0,15 mol D. CH3COOC2H3 0,15 mol.
Lời giải:
Đáp án: A
n
Este = n = 0Na
OH,3 mol; mmuối theo lí thuyết = 20,492/94 . 100 = 21,8 gam.
Meste = 22,2/0,3 = 74 gam/mol &r
Arr; cách làm phân tử của 2 este gồm dạng C3H6O2. Vậy công thức cấu tạo của nhì este là HCOOC2H5 với CH3COOCH3.
điện thoại tư vấn x là mol của HCOOC2H5 và y là số mol của CH3COOCH3. Ta bao gồm hệ
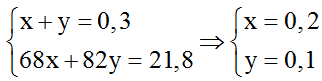
Bài 7: Xà phòng hoá trọn vẹn m gam lipit X bằng 200 gam dung dịch Na
OH 8% sau phản ứng nhận được 9,2 gam glixerol cùng 94,6 gam hóa học rắn khan. Công thức kết cấu của X là :
A. (C17H35COO)3C3H5. B. (C15H31COO)3C3H5.
C. (C17H33COO)3C3H5. D. (C17H31COO)3C3H5.
Lời giải:
Đáp án: D
Đặt công thức trung bình của lipit X là C3H5(OOCR)3.
C3H5(OOCR)3 + 3Na
OH → C3H5(OH)3 + 3RCOONa (1)
Theo đưa thiết ta gồm
&r
Arr; vì thế trong 94,6 gam chất rắn tất cả 0,1 mol Na
OH dư với 0,3 mol RCOONa.
&r
Arr; 0,1.40 + (R + 67).0,3 = 94,6 &r
Arr; R = 235 &r
Arr; R là C17H31–
Bài 8: Đun lạnh 66,3 gam etyl propionat cùng với 400 ml dung dịch Na
OH 2M, cô cạn hỗn hợp sau phản ứng cân nặng chất rắn nhận được là:
A. 62,4 gam.
B. 59,3 gam.
C. 82,45 gam.
D. 68,4 gam.
Lời giải:
Đáp án: D
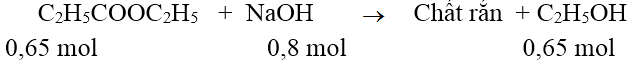
Bảo toàn cân nặng &r
Arr; chất rắn = 66,3 + 0,8.40 - 0,65.46 = 68,4 g
Cách khẳng định chỉ số xà chống hóa, chỉ số axit, chỉ số iot của hóa học béo
A. Phương thức & Ví dụ
Lý thuyết và phương pháp giải
- Số miligam KOH dùng làm trung hòa lượng axit từ do trong một gam chất phệ gọi là chỉ số axit của chất béo
- Chỉ số xà phòng của hóa học béo: là số miligam KOH phải để xà chống hóa triglixerit (tức chất béo) và trung hòa axit béo thoải mái trong gam hóa học béo.
- Chỉ số iot: là số gam iot rất có thể cộng vào 100 gam lipit. Chỉ số này dùng để đánh giá mức độ không no của lipit
Ví dụ minh họa
Bài 1: Để th-nc lượng axit béo tự do có vào 14 gam một mẩu chất béo phải 15ml dung dịch KOH 0,1M. Chỉ số axit của mẩu chất khủng trên là:
A. 6,0
B. 7,2
C. 4,8
D. 5,5
Hướng dẫn:
Theo định nghĩa: chỉ số axit của chất bự là số miligam KOH cần dùng để trung hòa hết các axit béo thoải mái có trong 1 gam hóa học béo.
Ta có: m
KOH = 0,015 x 0,1 x 56000 = 84 (mg)
&r
Arr; Chỉ số axit là: 84/14 = 6
Bài 2: Để tác dụng hết cùng với 100 gam lipit tất cả chỉ số axit bằng 7 đề nghị dùng 17,92 gam KOH. Cân nặng muối nhận được là:
A. 108,265 g
B. 170 g
C. 82,265 g
D. 107,57 g
Hướng dẫn:
Ta có: m
KOH đề xuất dùng = 7 x 100 = 700 mg = 0,7 (gam)
&r
Arr; n
KOH = 0,7/56 = 0,0125 (mol)
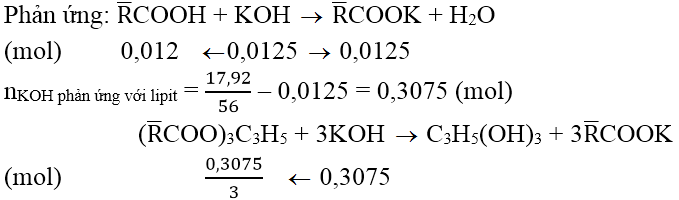
Vậy mmuối = 100 + m
KOH - m
H2O - mglixerol
= 100 + 17,92 – 0,0125 x 18 – 0,3075/3 x 92 = 108, 265 (gam)
Bài 3: Hãy tính cân nặng Na
OH cần dùng để làm trung hòa axit tự do thoải mái có trong 5 gam chất bự với chỉ số axit bằng 7.
Hướng dẫn:
Theo định nghĩa, chỉ số axit của chất béo bởi 7 nghĩa là muốn th-nc lượng axit phệ tự do trong một gam hóa học béo đề nghị dùng 7 mg KOH. Vậy muốn trung hòa - nhân chính axit béo tự do thoải mái trong 5 gam hóa học béo có chỉ số 7 thì cần dùng 5 * 7 = 35 mg KOH, giỏi 0,035/56 mol KOH
&r
Arr; 0,035/56 mol OH- &r
Arr; 0,035/56 mol Na
OH &r
Arr; cân nặng Na
OH buộc phải để trung hòa - nhân chính axit tự do trong 5 gam chất béo tất cả chỉ số axit bằng 7 là:
m
Na
OH = 0,035/56*40g = 25(mg) = 0,025g|5g hóa học béo
B. Bài xích tập trắc nghiệm
Bài 1: Để xà phòng hóa trọn vẹn 2,52 gam một lipit nên dùng 90ml dung dịch Na
OH 0,1M. Chỉ số xà phòng của lipit là:
A. 210
B. 150
C. 187
D. 200
Lời giải:
Đáp án: D
Ta có: n
KOH = n
Na
OH = 0,09 x 0,1 = 0,009 (mol)
&r
Arr; m
KOH = 0,009 x 56 = 0,504 (gam) = 504 (mg)
1 gam lipit cần: 504/2,52 = 200 (mg) KOH
Vậy chỉ số xà chống là 200
Bài 2: Khi th-nc 2,8 gam hóa học béo cần 3 ml hỗn hợp KOH 0,1M. Tính chỉ số axit chủa chất to đó.
A. 6 B. 5 C. 7 D. 8
Lời giải:
Đáp án: A
Ta có: n
KOH = 0,1 .0,003 = 0,0003 (mol)
&r
Arr; m
KOH = 0,0003 .56 = 0,0168(gam) = 16,8 (mg)
Vậy chỉ số axit = 16,8/2,8 = 6
Bài 3: Muốn trung hòa 5,6 gam một chất lớn X đó yêu cầu 6ml hỗn hợp KOH 0,1M. Hãy tính chỉ số axit của chất béo X cùng tính lượng KOH cần th-nc 4 gam chất béo bao gồm Y chỉ số axit bằng 7.
A. 5 với 14mg KOH
B. 4 cùng 26mg KOH
C. 3 với 56mg KOH
D. 6 và 28mg KOH
Lời giải:
Đáp án: D
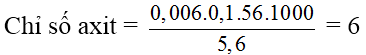
th-nc 4g hóa học béo buộc phải m
KOH = 4.7 = 28 (mg)
Bài 4: Chỉ số iot của triolein có mức giá trị bằng bao nhiêu?
A. 26,0
B. 86,2
C. 82,3
D. 102,0
Lời giải:
Đáp án: B
phản bội ứng: (C17H33COO)3C3H5 + 3I2 → (C17H33COOI2)3C3H5
&r
Arr; Chỉ số iot là: (3 × 254)/884 x 100 = 86,2
Bài 5: Số miligam KOH th-nc hết lượng axit tự do và xà chống của hóa học béo. Tính chỉ số xà phòng hóa của mẫu hóa học béo tất cả chỉ số axit bởi 7 chứa tritearoylglixerol còn lẫn một lượng axit stearic.
A. 175 B. 168 C. 184 D. 158
Lời giải:
Đáp án: A
cân nặng KOH th-nc axit: 0,007 (gam)
n
KOH = 0,007/56 = 0,125.10-3 (mol)
cân nặng C17H35COOH trong một gam chất mập là:
0,125.10-3.890 = 0,11125 (gam)
cân nặng tristearoyl glixerol trong một gam chất bự là: 0,8875 (gam)
≈0,001 (mol) &r
Arr; n
KOH = 0,003(mol) &r
Arr; m
KOH = 0,168(gam)
Chỉ số xà chống hóa là: 168 + 7 = 175.Bài 6: Để xà chống hóa 63 mg chất to trung tính yêu cầu 10,08 mg Na
OH. Khẳng định chỉ số xà chống của chất khủng đem dùng.









