So với sắt kẽm kim loại chiếm 80% vào bảng tuần hoàn hóa học thì phi kim chỉ chiếm khoảng 20%. Tuy nhiên chúng đóng một vai trò ko hề nhỏ dại trong cuộc sống. Vậy phi kim cụ thể là gì? đặc thù hóa học và tính chất vật lý của phi kim như vậy nào? các loại phi kim thường gặp? bài viết dưới phía trên của VIETCHEM đã giúp các bạn tìm đọc về chi tiết các vụ việc liên quan mang đến phi kim.
Bạn đang xem: Phi kim và kim loại
1. Phi kim là gì?
Phi kim là phần đa nguyên tố nằm bên phải vào bảng tuần trả hóa học. Do cấu trúc mà trong môi trường thiên nhiên không khí chúng thường tồn tại ở dạng phân tử. Đặc điểm vượt trội của phi kim là dễ dìm electron, chỉ trừ hidro. Phần lớn các phi kim hầu như dẫn nhiệt, dẫn điện kém, một trong những nguyên tố còn tồn tại sự biến đổi tính (ví dụ như cacbon).
Mỗi nguyên tố phi kim tất cả một tên gọi đi cùng rất kí hiệu riêng rẽ như B (Bo), C (Cacbon), N (Nito), O (Oxi), F (Flo), Ne (Neon), H (Hidro), He (Heli), tê mê (Silic), p (Photpho), S (Lưu huỳnh), Cl (Clo), Ar (Argon), As (Asen), Se (Selen), Br (Brom), Kr (Krypton), Te (Telu), I (Iot), xe cộ (Xenon), At (Astatin), Rn (Radon).
2. Phân các loại phi kim
Việc phân loại đúng mực phi kim còn những tranh cãi, vì chuyển tiếp giữa phi kim và sắt kẽm kim loại là á kim khó rất có thể phân biệt một bí quyết rõ ràng. Về cơ bản, phi kim bao gồm những đội sau:
Các khí thảng hoặc (He, Ne, Ar,...).Nhóm Halogen (F, Cl, Br, I).Các phi kim còn lại (C, N, O, P, S, Se).Một số nguyên tó như Bo, Si, Ge… được thừa nhận là á kim.3. Tính chất vật lý của phi kim
Mỗi một nhóm chất trong không gian đều phải có đặc trưng riêng với phi kim cũng vậy. Chúng gồm những đặc thù vật lý đáng chăm chú gồm:
Trạng thái tồn tại: khoảng tầm ½ phi kim (hidro, nito, oxi,... Là khí gồm màu cùng không màu. Phần còn sót lại chủ yếu đuối là thể rắn (như Photpho, Cacbon, giữ huỳnh,...), thể lỏng bao gồm một hóa học duy duy nhất dễ cất cánh hơi là Brom.Khả năng dẫn nhiệt: Chiếm nhiều phần phi kim giòn, dễ dàng gãy, đổ vỡ vụn và khả năng dẫn sức nóng kém, có những nguyên tố hoàn toàn không dẫn nhiệt.Khả năng dẫn điện: số đông các nhân tố của phi kim không dẫn điện.Nhiệt độ nóng chảy: So với sắt kẽm kim loại thì ánh sáng nóng rã của phi kim thấp.Tính độc: một số phi kim như Brom, Clo,... Là chất độc hại hại.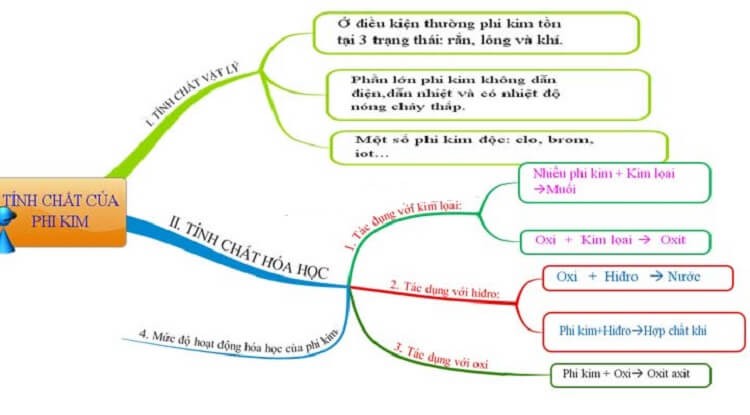
4. đặc thù hóa học tập của phi kim
Về đặc điểm hóa học, phi kim hoàn toàn có thể phản ứng cùng với kim loại, hidro, oxi trong các môi trường khác nhau. Nút độ hoạt động vui chơi của phi kim yếu tốt mạnh phụ thuộc vào tài năng cho electron của phi kim đó. Bọn chúng có xu thế nhận electron để tạo thành những hợp chất bền. Flo, Oxi là đều phi kim vận động mạnh có thể tham gia hầu hết các bội nghịch ứng đặc trưng của phi kim, trong các số ấy Flo là hoạt động mạnh nhất. Còn hầu như nguyên tố như Photpho, lưu giữ huỳnh, Silic, Cacbon,... Lại hoạt động yếu hơn do cần được nhận những electron hơn.
Các bội nghịch ứng đặc trưng của phi kim bao gồm:
4.1. Công dụng với kim loại
Nhiều phi kim tất cả khả năng tính năng với kim loại tạo thành muối bột hoặc oxit
Phi kim tính năng với sắt kẽm kim loại tạo thành muối.
S + sắt —> Fe
S
Kim nhiều loại để trong thô khí bao gồm phi kim là oxi thường tạo nên thành Oxit.
4Fe + 3O2 —-> 2Fe2O3
4.2. Chức năng với Hidro
Phi kim phản bội ứng với Hidro sản xuất thành hợp hóa học khí.Oxi tác dụng với Hidro tạo nên thành khá nước: O2 +2H2 —> 2H2OClo tính năng với khí Hidro: H2 + Cl2 —-> 2HClNgoài clo, nhiều phi kim khác ví như cacbon (C), diêm sinh (S), Brom (Br2),... Có thể phản ứng cùng với khí hidro tạo ra thành các hợp hóa học khí tương ứng.
4.3. Chức năng với Oxi
Nhiều phi kim chức năng với oxi sinh sản thành oxit axit như:
S + O2 —> SO2 không tồn tại màu
5. Ứng dụng của phi kim trong thực tế
Dù bao gồm những điểm sáng chung nhưng thực tiễn thì mỗi loại phi kim loại có rất nhiều ứng dụng khác nhau trong đời sống.
Còn than chì sử dụng làm ruột cây viết chì, đều nguyên tố hiếm như kim cưng cửng (thực hóa học là C trong môi trường thiên nhiên khắc nghiệt) hoàn toàn có thể làm những loại trang sức quý hiếm,...
Dưới đây là một vài ba ứng dụng trông rất nổi bật của những loại phi kim phổ biến:
Brom: Phi lim này được dùng để làm sản xuất vật tư chống cháy, giải pháp xử lý nước trong bể bơi… Đặc biệt nó tất cả vai trò quan trọng đặc biệt trong dược phẩm chữa các bệnh ung thư với alzheimer.Lưu huỳnh: Ứng dụng trong tương đối nhiều ngành nghề khác như như để sản xuất axit H2SO4, cấp dưỡng diêm tạo đk đánh lửa, thuốc súng, pháo hoa, bột giặt. Sulfur còn được thực hiện để chế tạo thuốc khử nấm trừ sâu bệnh và phân bón giúp cây cỏ phát triển cùng đạt năng xuất cao. Ngoài ra, diêm sinh còn rất có thể sản xuất lốp xe cao su và các vật liệu khác.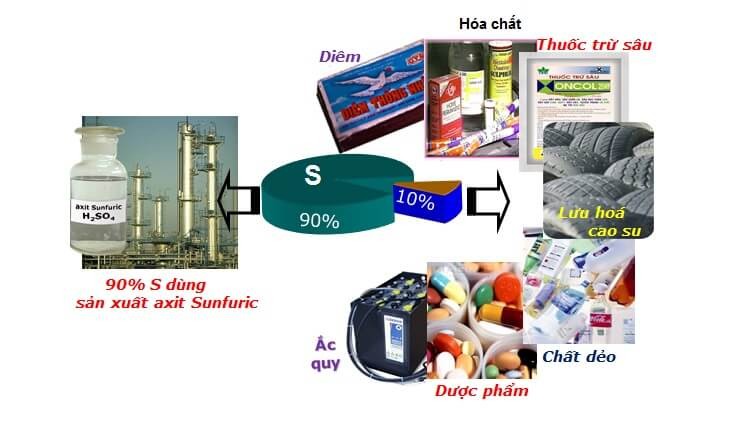
- Oxi là nguyên tố quan trọng quan trọng so với sự sinh sống còn của con tín đồ và rượu cồn vật. Oxi trong không khí góp thực hiện tác dụng hô hấp. Giữa những môi ngôi trường thiếu không gian như bên dưới biển, hầm mỏ… bạn ta nên bình khí oxy để thở.
- bên cạnh ra, nó là môi trường thiên nhiên thiết yếu để để đốt cháy nhiên liệu. Trong cung ứng gang thép, bạn ta rất cần phải thổi khí oxi vào lò thì mới có thể tạo ánh sáng cao triển khai các vận động thiết yếu, nâng cấp hiệu suất cũng như quality thành phần.
Nito: Nitơ là phi kim phổ cập trong từ bỏ nhiên, nó được thực hiện trong hàn mặt đường ống, bơm lốp ô tô, đồ vật bay, bảo quản thực phẩm đóng góp gói…Clo: vào sinh hoạt thường xuyên ngày, Clo được sử dụng để khử trùng nước sinh hoạt. Kế bên ra, nó còn được dùng để làm tẩy trắng sợi vải, điều chế chất dẻo,...Các nguyên tố rất có thể được phân một số loại là kim loại, phi kim hoặc á kim. Kim loại là hóa học dẫn nhiệt với điện tốt, bên cạnh đó dẽ uốn nắn (rèn thành tấm) với dẻo (kéo thành dây). Phần nhiều các sắt kẽm kim loại là chất rắn ở ánh nắng mặt trời phòng, có ánh bạc đặc trưng (ngoại trừ thủy ngân là chất lỏng).
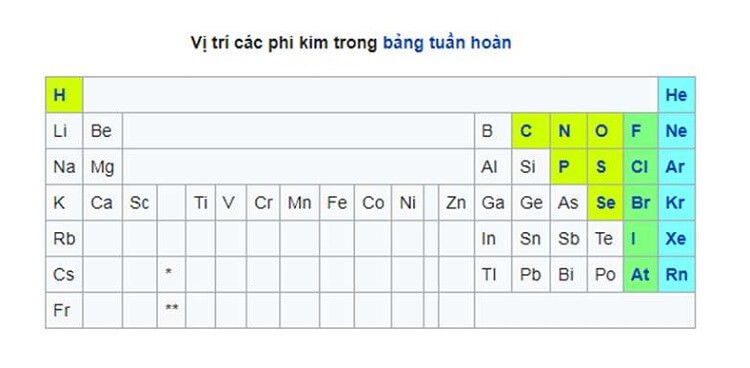
Vị trí của kim loại, phi kim, á kim trong bảng tuần hoàn hóa học
Phi kim hay là hóa học dẫn điện và nhiệt kém, rất khó uốn hoặc kéo sợi, nhiều phi kim là hóa học khí ở ánh nắng mặt trời phòng. Trong khi một trong những chất khác là lỏng hoặc rắn.
Các á kim là trung gian trong tính chất của chúng. Về tính chất vật lý, chúng giống phi kim hơn, nhưng mà trong một vài trường hợp tuyệt nhất định, một vài trong những chúng rất có thể dẫn điện. đa số chất buôn bán dẫn này cực kỳ quan trọng trong laptop và những thiết bị năng lượng điện tử khác.
Trên nhiều bảng tuần hoàn, một con đường màu đen gồm răng cưa (xem hình mặt dưới) dọc theo phía bên nên của mặt đường phân tách kim loại với phi kim. Các kim loại nằm tại vị trí bên trái của vạch (ngoại trừ hydro là phi kim), các á kim nằm ở vị trí bên cần của gạch và những nguyên tố ngay gần cạnh vạch là á kim.

Khi những nguyên tố phối kết hợp để chế tác thành đúng theo chất. Bao gồm hai loại link chính có thể xảy ra. Link ion ra đời khi tất cả sự đưa electron từ bỏ nguyên tử này thanh lịch nguyên tử khác. Tạo ra các ion điện tích hút nhau rất mạnh khỏe bằng địa chỉ tĩnh năng lượng điện và links cộng hóa trị. Tạo thành khi những nguyên tử chia sẻ electron để tạo nên các phân tử trung hòa.
Nói chung, sắt kẽm kim loại và phi kim dễ kết phù hợp với nhau để chế tạo ra thành hợp hóa học ion, trong khi phi kim kết phù hợp với phi kim không giống để chế tác thành hợp chất cộng hóa trị (phân tử).
Xem thêm: Mây họa ánh trăng kênh 14 - review phim mây họa ánh trăng
Vị trí của kim loại trong bảng tuần trả hóa học
Vì những kim một số loại nằm xa rộng về phía phía trái của bảng tuần hoàn, vậy cần chúng có năng lượng ion hóa thấp với ái lực với electron thấp. Vị vậy chúng mất electron tương đối thuận tiện và cạnh tranh thu được electron.
Chúng cũng đều có tương đối ít electron hóa trị và có thể tạo thành ion (thỏa mãn quy tắc chén bát tử) thuận lợi hơn bằng phương pháp mất đi các electron hóa trị để chế tác thành cation tích năng lượng điện dương.
Các kim loại nhóm thiết yếu thường tạo thành thành các điện tích hệt như số đội của chúng. Nghĩa là những kim nhiều loại nhóm 1A như natri với kali sản xuất thành điện tích +1, các kim loại nhóm 2A như magie và canxi tạo thành điện tích +2. Những kim một số loại nhóm 3A như nhôm chế tác thành năng lượng điện 3+.
Vị trí của á kim trong bảng tuần trả hóa học
Các kim loại theo sau các kim nhiều loại chuyển tiếp (về bên dưới cùng của nhóm 4A với 5A) rất có thể mất đi những electron s với p lớp ngoài cùng của chúng. Sản xuất thành các điện tích đồng nhất với số đội của chúng hoặc chỉ mất đi các electron p trong những lúc vẫn duy trì hại hai s. Những electron sinh sản thành điện tích ngay số nhóm trừ đi hai.
Nói cách khác, thiếc và chi trong team 4A có thể tạo thành năng lượng điện + 4 hoặc + 2. Trong những khi bismuth team 5A rất có thể tạo thành năng lượng điện 5+ hoặc 3+.
Các kim loại chuyển tiếp thường có công dụng tạo thành điện tích 2+ bằng phương pháp mất đi các electron hóa trị của chúng. Cơ mà cũng có thể mất đi các electron từ bỏ quỹ đại d của bọn chúng để chế tạo ra thành những điện tích khác.
Hầu hết các kim một số loại chuyển tiếp có thể hình thành nhiều hơn thế một hóa trị trong số hợp hóa học ion.
Vị trí củaphi kimtrong bảng tuần trả hóa học
Các phi kim ở xa hơn về phía bên buộc phải của bảng tuần hoàn cùng có năng lượng ion hóa cao cùng ái lực electron cao. Vị vậy bọn chúng thu các electron tương đối dễ và cạnh tranh mất chúng. Chúng cũng có thể có số lượng electron hóa trị to hơn và đã sắp đạt cỗ tám hoàn chỉnh.
Các phi kim dấn electron cho tới khi chúng có cùng số electron cùng với khí hiếm sớm nhất (nhóm 8A). Tạo thành các anion năng lượng điện âm gồm điện tích bằng tám trường đoản cú đi số nhóm.
Nghĩa là, phi kim team 7A chế tạo ra thành 1 điện tích, phi kim team 6A tạo thành thành 2 điện tích và kim loại nhóm 5A sinh sản thành 3 điện tích. Những nguyên tố team 8A đã tất cả tám electron trong bự vỏ hóa trị của chúng và có rất ít xu hướng nhận hoặc mất electron. Và không dễ ợt tạo thành những hợp hóa học ion hoặc cộng hóa trị.
Các loại link của kim loại, phi kim, á kim
Các hợp chất ion được links với nhau thành một mảng thông thường được điện thoại tư vấn là mạng tinh thể bởi lực hút giữa các cation cùng anion tích năng lượng điện trái dấu. Các lực cuốn hút này rất bạo gan và vị đó phần nhiều các hợp hóa học ion đều phải sở hữu điểm nóng chảy không hề nhỏ (Ví dụ: natri clorua, Na
Cl, rét chảy ngơi nghỉ 801 độ, trong khi nhôm oxit, Al2O3, lạnh chảy sinh sống 2054 độ).
Các hợp hóa học ion hay cứng, rắn chắn chắn và giòn. Các hợp chất ion ko dẫn điện, vì các ion không tự do di chuyển trong pha rắn, nhưng những hợp hóa học ion có thể dẫn điện khi chúng hòa tung trong nước.
Khi các phi kim kết phù hợp với các phi kim khác, chúng có xu hướng chia sẻ các electron trong links cộng hóa trị thay vị tạo thành các ion, dẫn tới việc hình thành những phân tử trung tính. (Hãy ghi nhớ rằng bởi hydro cũng là 1 trong phi kim buộc phải sự phối hợp của hydro với cùng một phi kim khác cũng trở nên tạo ra link cộng hóa trị).
Các hợp hóa học phân tử rất có thể là chất khí, dạng lỏng hoặc hóa học rắn có điểm nóng chảy rẻ và bao gồm nhiều một số loại chất khác nhau.
Khi những kim loại kết hợp với nhau, links đó thường được diễn tả là links kim loại. Trong quy mô này, mỗi nguyên tử kim loại tặng một hoặc các electron hóa trị của chính nó để tạo nên một biển cả electron phủ bọc tất cả các nguyên tử, giữ chất này lại với nhau bởi lực hút giữa các cation kim loại và những electron sở hữu điện tích âm.
Vì những electron trong biển khơi electron có thể di chuyển tự do thoải mái nên sắt kẽm kim loại dẫn điện rất đơn giản dàng, không giống hệt như các phân tử, nơi các electron được cố định và thắt chặt nhiều hơn.
Các nguyên tử kim loại hoàn toàn có thể di chuyển sang nhau tiện lợi hơn so với những nguyên tử trong hợp chất ion (được giữ thắt chặt và cố định bởi lực hút giữa cation với anion), chất nhận được kim các loại được dập thành tấm hoặc kéo dây.
Các kim loại khác nhau có thể được kết hợp rất thuận lợi để tạo thành hợp kim, tất cả thể có không ít tính hóa học vật lý khác với những kim nhiều loại cấu thành của chúng.
Thép là hợp kim của sắt cùng cacbon, cứng hơn nhiều so với phiên bản thân sắt. Crom, vanadi, niken và những kim loại khác cũng hay được cung cấp sắt để tạo ra các một số loại thép. Đồng thau cũng chính là một kim loại tổng hợp của đồng cùng kẽm được thực hiện trong đường ống, lắp thêm điện, nhạc cụ.
Đồng đỏ là kim loại tổng hợp của đồng và thiếc, cứng hơn nhiều so với đồng. Khi đồ vật đồng được phát hiện bởi các nền cao nhã cổ đại, nó đã khắc ghi một cách tiến đáng kể so với việc sử dụng các công cụ bằng đá điêu khắc kém bền hơn.









